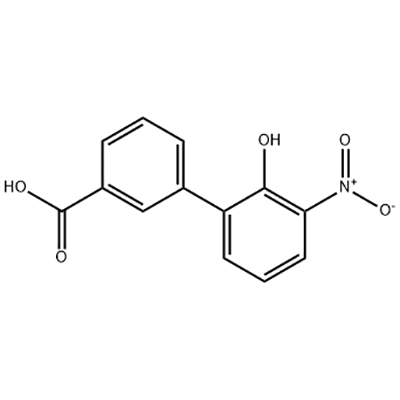
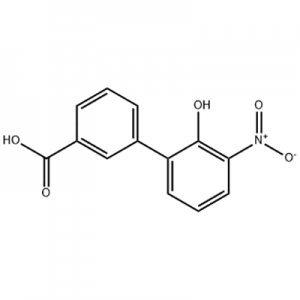
ácido 2'-hidroxi-3'-nitro-3-bifenilcarboxílico
ácido 2'-hidroxi-3'-nitro-3-bifenilcarboxílico
O ácido 2'-hidroxi-3'-nitro-3-bifenilcarboxílico é usado como intermediário de Eltrombopag.
O eltrombopag, desenvolvido pela GlaxoSmithKline (GSK) no Reino Unido e posteriormente desenvolvido em conjunto com a Novartis na Suíça, é o primeiro e único agonista do receptor TPO não peptídico de molécula pequena aprovado no mundo.O eltrombopag foi aprovado pelo FDA dos EUA em 2008 para o tratamento da púrpura trombocitopênica idiopática (PTI) e em 2014 para o tratamento da anemia aplástica grave (AA).É também o primeiro medicamento aprovado pelo FDA dos EUA para o tratamento da AA nos últimos 30 anos.
Em dezembro de 2012, o FDA dos EUA aprovou o Eltrombopag para o tratamento de trombocitopenia em pacientes com hepatite C crônica (CHC), para que pacientes com hepatite C com prognóstico ruim devido à baixa contagem de plaquetas possam iniciar e manter a terapia padrão baseada em interferon para doenças hepáticas.Em 3 de fevereiro de 2014, a GlaxoSmithKline anunciou que o FDA concedeu a qualificação de medicamento de tratamento inovador de Eltrombopag para o tratamento de hemopenia em pacientes com anemia aplástica química grave (SAA) que não responderam totalmente à imunoterapia.Em 24 de agosto de 2015, o FDA dos EUA aprovou o Eltrombopag para o tratamento de trombocitopenia em adultos e crianças com 1 ano de idade ou mais com trombocitopenia imune crônica (PTI) que apresentam resposta insuficiente a corticosteroides, imunoglobulinas ou esplenectomia.Em 4 de janeiro de 2018, o Eltrombopag foi aprovado para ser listado na China para o tratamento da trombocitopenia imune primária (PTI).


![Casp ungin Acetate;Caspofungina acetato;Cancidas;Caspofungina acetato [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)


![2-butil-5-nitro-3-benzofuranil)[4-[3-(dibutilaMino)propoxi]fenil]](http://cdn.globalso.com/jindunchem-med/922e79ba.jpg)
